следствие того что сахарный диабет I типа инсулинзависимый, введение инсулина является единственно возможным средством лечения данной категории больных. Не существует альтернативы подкожной заместительной терапии инсулином, хотя она и представляет собой лишь имитацию физиологического действия инсулина. В нормальных условиях инсулин поступает в систему воротной вены, далее – в печень, где наполовину инактивируется, оставшаяся часть оказывается на периферии. Все это происходит настолько быстро, что уровень гликемии может поддерживаться в довольно узких пределах даже после еды. Иной путь наблюдается у инсулина, введенного под кожу: он с опозданием попадает в кровоток и тем более в печень, после чего концентрация инсулина в крови длительное время остается нефизиологически повышенной. Это несовершенство подкожной инсулинотерапии и объясняет тот факт, что больные диабетом вынуждены проводить самоконтроль обмена веществ, учет своего питания, физических нагрузок и других факторов, влияющих на уровень гликемии. Но современная стратегия и тактика инсулинотерапии позволяют сделать образ жизни больных сахарным диабетом I типа очень близким к нормальному. Осуществить это можно только путем обучения больных сахарным диабетом.
Необходимость применения программ обучения при сахарном диабете признана уже давно. Еще в 1925 г. один из пионеров инсулинотерапии Э. Джослин обучал больных тому, что считал главным для успеха лечения: ежедневному трехкратному определению глюкозурии и изменению дозы инсулина на основании полученных данных. Необходимость стационарного лечения возникала при этом редко. Но с появлением препаратов инсулина пролонгированного действия развитие инсулинотерапии пошло по другому пути. Больным было запрещено самостоятельно изменять дозу инсулина, они вводили инсулин пролонгированного действия лишь 1 раз в сутки, и на долгие годы им пришлось забыть о нормальном питании, смириться с повышенным риском гипогликемий и необходимостью частых госпитализаций. К началу 80-х годов диабетологи располагали препаратами инсулина высокой степени очистки, инсулином человека, усовершенствованными средствами для введения инсулина (одноразовые инсулиновые шприцы и шприцы-ручки), методами экспресс-анализа гликемии и глюкозурии с помощью тест-полосок. Вопреки ожиданиям, их применение само по себе не привело к уменьшению числа поздних осложнений диабета и стойкому улучшению компенсации углеводного обмена. По единодушному заключению специалистов требовался новый подход, который позволил бы эффективно управлять этим сложным хроническим заболеванием путем вовлечения самого больного в активный контроль за диабетом и его лечением. В настоящее время термин “терапевтическое обучение” официально признан Всемирной организацией здравоохранения, и оно является обязательной и интегральной частью лечения сахарного диабета любого типа. В отношении больных сахарным диабетом I типа это прежде всего означает, что больной должен стать грамотным “инсулинотерапевтом”.
Инсулинотерапия является общепризнанной стратегией лечения больных сахарным диабетом I типа.
Общепризнанной стратегией лечения больных сахарным диабетом I типа является интенсифицированная инсулинотерапия. Под интенсифицированной инсулинотерапией подразумевается режим многократных инъекций инсулина, имитирующий физиологическую секрецию инсулина b-клетками. Как известно, в физиологических условиях базальная (фоновая) секреция инсулина происходит непрерывно (в том числе и в отсутствие приема пищи, и ночью) и составляет около 1 ЕД инсулина в час (рис. 1, а). При физической нагрузке инсулиновая секреция в норме заметно уменьшается. Чтобы поддержать гликемию в пределах нормы во время еды, требуется значительная добавочная (стимулированная) секреция инсулина (около 1–2 ЕД на каждые 10 г углеводов). Эту сложную кинетику секреции инсулина с относительно постоянным базальным и варьирующим алиментарным уровнем можно имитировать следующим образом: перед приемами пищи больной вводит различные дозы инсулина короткого действия, а фоновая инсулинемия поддерживается инъекциями инсулина пролонгированного действия. Такой вид инсулинотерапии называется также базис-болюсной инсулинотерапией.
Как бы ни приближалась интенсифицированная инсулинотерапия к физиологическим условиям, не следует забывать, что профиль действия простого инсулина, введенного подкожно, не совсем точно соответствует физиологической кинетике алиментарной секреции инсулина. Этот вид инсулинотерапии также подразумевает, что больной ежедневно несколько раз определяет уровень глюкозы крови и учитывает эти показатели при выборе дозы инсулина. Как правило, больные делают инъекции инсулина короткого действия перед едой трижды в сутки, иногда и чаще. Базальная потребность в инсулине покрывается чаще всего двумя инъекциями инсулина пролонгированного действия в сутки. Наиболее частой схемой интенсифицированной инсулинотерапии является следующая комбинация инъекций:
• утром (перед завтраком) – введение инсулина короткого и пролонгированного действия;
• днем (перед обедом) – введение инсулина короткого действия;
• вечером (перед ужином) – введение инсулина короткого действия;
• на ночь – введение инсулина пролонгированного действия (рис. 1, б).
Такая схема является базовой, у каждого больного в определенные дни она может претерпевать изменения: количество инъекций инсулина короткого действия может быть больше или меньше в зависимости от конкретных обстоятельств (например, дополнительные приемы пищи, неожиданно высокие цифры сахара крови, сопутствующие заболевания и др.). Говоря о дозах инсулина, следует подчеркнуть, что не может быть раз и навсегда “подобранной” дозы инсулина, она достаточно часто будет изменяться в соответствии с изменениями образа жизни больного. Поэтому нет смысла рассчитывать дозы для конкретного больного, исходя из теоретических предпосылок (суточная доза на 1 кг массы тела, дневная и ночная потребность, соотношение базального и прандиального уровней инсулина и т.д.), – все это будут лишь среднестатистические величины. Единственным критерием, позволяющим правильно определить дозу инсулина, являются цифры гликемии, измеряемой самим больным.

Рис. 1. Физиологическая секреция инсулина и режим интенсифицированной инсулинотерапии
При подборе дозировки инсулина пролонгированного действия не следует забывать, что профиль действия инсулина зависит и от величины дозы: меньшая доза действует менее продолжительное время, чем большая. Это может привести к такой ситуации, когда слишком маленькая утренняя доза инсулина пролонгированного действия не позволяет обеспечить достаточной базальной инсулинемии ко времени ужина (обычно в таких случаях говорят, что инсулин “не дотягивает”), поэтому уровень глюкозы крови перед ужином заметно повышается (рис. 2, а). В этом случае необходимо либо делать дополнительную инъекцию инсулина короткого действия в полдник (рис. 2, б), либо посоветовать больному вводить небольшую добавочную дозу инсулина пролонгированного действия перед обедом (рис. 2, в). Таким образом, иногда возникает необходимость в трехкратном введении инсулина пролонгированного действия в сутки. Такой вариант инсулинотерапии встречается все чаще и чаще.
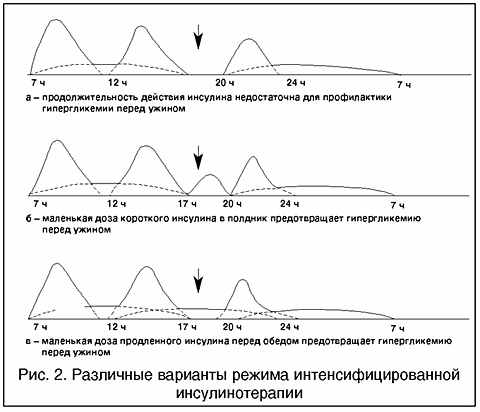
Рис. 2. Различные варианты режима интенсифицированной инсулинотерапии
В настоящее время преимущественное распространение получили препараты человеческого инсулина. При этом в качестве инсулинов пролонгированного действия наиболее удобно пользоваться препаратами НПХ-инсулина, потому что их в отличие от цинк-инсулинов можно смешивать в одном шприце и вводить вместе с инсулином короткого действия. Говоря о последних достижениях в области интенсифицированной инсулинотерапии, следует отметить появление на рынке так называемых короткодействующих аналогов инсулина человека, или инсулинов ультракороткого действия. Дело в том, что при подкожной инъекции простого инсулина его действие начинается через 30–40 мин, концентрация в сыворотке достигает пика позднее (2–4 ч после инъекции) и остается повышенной дольше (длительность действия до 6–8 ч), чем при нормальной секреции инсулина поджелудочной железой. Чтобы свести к минимуму этот недостаток лечения, подкожные инъекции человеческого инсулина короткого действия обычно рекомендуют производить примерно за полчаса до еды, а в промежутках между основными приемами пищи делать дополнительные “перекусы”. Это может создать существенные неудобства для больных, особенно для тех, кто ведет активный образ жизни. Путем изменения структуры молекулы человеческого инсулина можно получить аналоги с новыми свойствами. После подкожной инъекции это ведет к более быстрому всасыванию (0–15 мин), более быстрому наступлению пика действия (45–60 мин) и более короткой продолжительности действия (3–4 ч) по сравнению с обычным инсулином. Профиль действия такого инсулина обеспечивает больным большую гибкость в отношении режима дня, питания и физической активности.
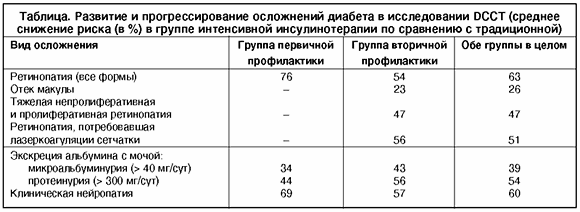
В настоящее время неопровержимо доказано, что для предотвращения поздних осложнений сахарного диабета самым главным является постоянное поддержание уровня гликемии, близким к нормальному. У больных сахарным диабетом I типа достичь этого можно только с помощью интенсифицированной инсулинотерапии. Самым крупным исследованием, посвященным изучению влияния интенсифицированной инсулинотерапии и хорошего контроля сахарного диабета на частоту и степень тяжести поздних осложнений, явилось многоцентровое исследование DCCT (Diabetes Control and Complications Trial). Оно проводилось с 1982 по 1993 г. в 29 диабетологических центрах США и Канады. В исследовании участвовал 1441 больной сахарным диабетом I типа, пациенты были разделены на 2 группы. 1-я группа включала 726 человек без осложнений (группа первичной профилактики), 2-я – 715 человек с признаками диабетической ретинопатии (группа вторичной профилактики). В каждой группе одним пациентам назначалась традиционная терапия, а другим – интенсивная. Целью традиционной терапии была клиническая компенсация – отсутствие симптомов гипергликемии, кетонурии, частых и тяжелых гипогликемий. Достигалось это за счет одной или двух инъекций инсулинов короткого и пролонгированного действия, периодического самоконтроля гликемии или глюкозурии, обучения принципам диеты. Больные, как правило, не проводили самостоятельной ежедневной коррекции доз инсулина, обследование выполнялось 1 раз в 3 мес. При интенсивной терапии преследовались те же клинические цели, а кроме того, поддержание гликемии на уровне, максимально приближенном к таковому у здоровых людей (3,9–6,7 ммоль/л перед едой и менее 10 ммоль/л после еды). Интенсивная терапия предусматривала режим многократных инъекций инсулина (3 в день и более) или использование носимого дозатора инсулина, частое (4 раза в день и более) измерение уровня гликемии, обучение больных принципам самостоятельной адаптации доз инсулина. Больные посещали свой центр ежемесячно, регулярно связывались с врачом по телефону. У больных обеих групп регулярно измеряли уровень гликированного гемоглобина (объективно свидетельствующего о степени компенсации углеводного обмена), а также проводили тесты для оценки ретинопатии (фотографирование глазного дна), нефропатии (микроальбуминурия, протеинурия, клубочковая фильтрация) и нейропатии. Продолжительность наблюдения за больными колебалась от 3 до 9 лет (средняя составила 6,5 лет). На протяжении всего исследования уровень гликированного гемоглобина HbA1c в группе интенсивного лечения поддерживался на уровне, близком к 7%, тогда как в группе с традиционной инсулинотерапией он был около 9% (т.е. таким же, как исходный). Было показано, что развитие и прогрессирование диабетической ретинопатии в группе интенсивной терапии снизилось почти на 60%, тяжелой непролиферативной и пролиферативной ее форм, требующих лазеркоагуляции, – на 50%. В результате интенсивной терапии на 34–56% снизилась частота диабетической нефропатии, оцениваемая по уровню экскреции белка с мочой. Также статистически достоверно снизилась частота клинической нейропатии (на 60%) и макрососудистых осложнений (на 41%). Риск снижения различных осложнений в группах первичной и вторичной профилактики показан в таблице.
На первый взгляд интенсифицированная инсулинотерапия кажется обременительной для больных, в конечном же счете благодаря ей качество жизни пациентов повышается, поскольку они свободно изменяют как состав пищи, так и время ее приема. При введении инсулина короткого действия перед едой больные обучаются заранее выбирать необходимую его дозу в зависимости от запланированного на этот прием количества углеводов (в том числе разрешается употреблять в небольшом количестве сладости), которое они могут произвольно менять, и величины гликемии в данный конкретный момент. Являясь основой лечения сахарного диабета I типа, интенсифицированная инсулинотерапия не может рассматриваться отдельно от других его важнейших компонентов – самоконтроля обмена веществ, либерализованной диеты, учета физической активности и обучения, в противном случае достигнутый лечебный эффект будет минимальным. Было бы ошибочным считать, что сам по себе перевод больного на режим многократных инъекций автоматически значительно улучшит компенсацию. Некоторые больные и сегодня отказываются от интенсифицированной инсулинотерапии не только из-за необходимости частых инъекций, но и потому, что не знают тех преимуществ, которые она дает. С этой точки зрения обучение больных диабетом должно играть основную роль в формировании мотивации к переходу на более сложный, но и более эффективный путь лечения данного заболевания.
Литература:
1. Анциферов М.Б., Майоров А.Ю., Ристич С. и др. Глюкодинамика и фармакокинетика аналога инсулина (Хумалога) у больных инсулинзависимым сахарным диабетом. Клин. фармакол. и тер. 1997; 6 (1): 68-70.
2. Бергер М., Старостина Е.Г., Йоргенс В., Дедов И.И. Практика инсулинотерапии. 1-е рус. изд. Berlin, Springer-Verlag, 1995.
3. Дедов И.И., Анциферов М.Б., Галстян Г.Р. и др. Обучение больных сахарным диабетом. М., 1999.
4. Дедов И., Йоргенс В., Старостина Е. и др. Книга о сахарном диабете. Руководство для больных сахарным диабетом, получающих инсулин. 1-е рус. изд. Mainz, Kirchheim-Verlag; 1990.
5. Кохен М. Сахарный диабет. Краткое руководство по лечению. М., 1997.
6. Старостина Е.Г. Интенсивная инсулинотерапия при сахарном диабете I типа. Клин. фармакол. и тер. 1993; 3: 58-63.
7. A Desktop Guide to Type 1 (Insulin-dependent) Diabetes Mellitus. European Diabetes Policy Group. Brussels, 1998.
8. Hirsch B., Farkas-Hirsch R., Skyler S. Intensive insulin therapy for treatment of type 1 diabetes. Diabetes Care 1990; 1: 1265-83.
9. The Diabetes Control and Complications Trial Research Group. The effects of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977-86.
При прогрессирующем снижении остаточной секреции β-клеток, неэффективности терапии ПССП назначается инсулин, препараты которого на российском рынке представлены и зарубежными, и отечественными производителями (актрапид, протофан, хумулин, биосулин и др.), как в виде монотерапии, так и в комбинации с таблетированными сахароснижающими препаратами. В инсулинотерапии, по скромным подсчетам, нуждаются около 40% больных сахарным диабетом 2 типа, однако реально получают инсулин менее 10% больных. Анализ клинической практики лечения СД 2 типа свидетельствует о позднем начале инсулинотерапии, а также о неудовлетворительной метаболической компенсации диабета, даже на фоне инсулинотерапии (низкие дозы инсулина). Это может случиться либо по вине врача — из-за опасения прибавки веса и развития гипогликемии, либо из-за негативного отношения пациента к данному виду терапии — при отсутствии регулярного самоконтроля гликемии. Обычно инсулинотерапию назначают больным, имеющим длительное, более 10–15 лет, течение сахарного диабета и выраженные сосудистые осложнения.
Показания к инсулинотерапии у больных СД 2 типа
- Признаки дефицита инсулина (кетоз, потеря массы тела).
- Острые осложнения СД.
- Впервые выявленный СД с высокими показателями гликемии натощак и в течение дня, без учета возраста, предполагаемой продолжительности заболевания, массы тела.
- Острые макроваскулярные заболевания, необходимость хирургического лечения, тяжелые инфекции и обострение хронических заболеваний.
- Впервые выявленный СД 2 типа при наличии противопоказаний к применению пероральных сахароснижающих препаратов (нарушение функции печени, почек, аллергические реакции, гематологические заболевания).
- Тяжелые нарушения функции печени и почек.
- Беременность и лактация.
- Отсутствие удовлетворительного гликемического контроля при терапии максимальными дозами ПССП в допустимых комбинациях наряду с адекватными физическими нагрузками.
В последнее время врачи осознали необходимость проведения инсулинотерапии для ликвидации глюкозотоксичности и восстановления секреторной функции β-клеток при умеренной гипергликемии. На первых этапах заболевания дисфункция β-клеток носит обратимый характер и эндогенная секреция инсулина восстанавливается при снижении гликемии. Ранняя инсулинотерапия у больных СД 2 типа хотя и не является традиционной, но представляется одним из возможных вариантов медикаментозного лечения при плохом метаболическом контроле на этапе диетотерапии и физических нагрузок, минуя этап ПССП. Данный вариант наиболее оправдан у пациентов, которые предпочитают терапию инсулином использованию других сахароснижающих препаратов, пациентам с дефицитом массы тела, а также при вероятности латентного аутоиммунного диабета взрослых (LADA).
Успешное снижение гепатической продукции глюкозы при СД 2 типа требует ингибирования двух процессов: глюконеогенеза и гликогенолиза. Поскольку введение инсулина способно снизить глюконеогенез и гликогенолиз в печени и улучшить периферическую чувствительность к инсулину, появляется возможность оптимальной коррекции основных патогенетических механизмов СД 2 типа. Положительными эффектами инсулинотерапии больных сахарным диабетом 2 типа являются:
- снижение тощаковой и постпрандиальной гипергликемии;
- снижение глюконеогенеза и продукции глюкозы печенью;
- усиление секреции инсулина в ответ на прием пищи или стимуляцию глюкозой;
- подавление липолиза в постпрандиальном периоде;
- подавление секреции глюкагона после приема пищи;
- стимуляция антиатерогенных изменений в профиле липидов и липопротеинов;
- снижение неспецифического гликирования белков и липопротеинов;
- улучшение аэробного и анаэробного гликолиза.
Лечение больных СД 2 типа в первую очередь направлено на достижение и длительное поддержание целевых уровней HbA1c, гликемии как натощак, так и после приема пищи, что приводит к снижению риска развития и прогрессирования сосудистых осложнений.
В настоящее время отсутствуют четкие рекомендации относительно выбора начальной дозы инсулина. В основном подбор производится на основании оценки клинического состояния, с учетом суточного профиля глюкозы, массы тела больного. Потребность в инсулине зависит от инсулинсекреторной способности β-клеток, сниженной на фоне глюкозотоксичности, степени инсулинорезистентности. Пациентам с СД 2 типа и ожирением, имеющим инсулинорезистентность различной степени выраженности, для достижения метаболического контроля может потребоваться 1 и более ЕД инсулина на 1 кг массы тела в сутки. Наиболее часто назначается болюсная инсулинотерапия, когда инсулин короткого действия (или аналог человеческого инсулина) применяется несколько раз в день, возможна комбинация инсулина короткого и промежуточного действия (перед сном или два раза в день) или аналога пролонгированного инсулина (перед сном). Количество инъекций и суточная доза инсулина зависят от уровня гликемии, пищевого режима и общего состояния больного.
- при наличии временных противопоказаний к приему пероральных сахароснижающих препаратов;
- во время длительных воспалительных заболеваний;
- при глюкозотоксичности и необходимости восстановления секреторной функции β-клеток.
В таких случаях назначаются инсулин короткого действия (2–3 раза) и пролонгированный инсулин перед сном или два раза в день под контролем гликемии, а ПССП обычно отменяются.
После устранения глюкозотоксичности, при стойкой нормализации показателей гликемии, снижении уровня HbA1c, положительной динамике в общем, соматическом статусе больного и сохранной эндогенной секреции инсулина на фоне временной инсулинотерапии, под контролем гликемии постепенно назначаются ПССП, а суточная доза инсулина медленно уменьшается. Другим вариантом является комбинированная терапия инсулином и ПССП.
При сниженной эндогенной секреции инсулина назначается монотерапия инсулином.
К преимуществам комбинированной терапии относится лучшая мотивация пациента, быстрое устранение глюкозотоксичности, улучшение чувствительности периферических тканей к инсулину и повышение эндогенной секреции инсулина.
Монотерапия инсулином у больных СД 2 типа проводится как в режиме традиционной инсулинотерапии, так и интенсифицированной инсулинотерапии (базис-болюсной). Значительный прогресс диабетологии связан с широким арсеналом различных видов инсулина, и практикующие врачи имеют возможность выбирать лечение, идя навстречу потребностям и возможностям пациента. В лечении СД 2 типа применимы любые режимы инсулинотерапии, позволяющие успешно контролировать гипергликемию и избежать нежелательной гипогликемии.
Возможные варианты режимов инсулинотерапии
- Одна инъекция инсулина промежуточного действия или аналога инсулинового пролонгированного действия перед сном или перед завтраком; готовая смесь инсулина в пропорции 30 : 70 в режиме одной инъекции (перед завтраком или перед ужином) или 2–3 инъекций (перед завтраком и перед ужином, или перед завтраком, перед обедом и перед ужином).
- Комбинация инсулина промежуточного (в 1–2 инъекции) или аналогов пролонгированного действия и инсулина короткого либо аналогов сверхкороткого действия, вводимых перед основными приемами пищи.
Наиболее важная составляющая инсулинотерапии — это применение адекватных доз инсулина, обеспечивающих достижение и длительное поддержание целевых уровней гликемии, а не выбор того или иного варианта режима терапии.
Преимуществом инсулина по сравнению с ПССП является то, что ранняя инсулинотерапия у больных СД 2 типа лучше сохраняет эндогенную секрецию инсулина и обеспечивает более полный метаболический контроль (таблица).
Самым эффективным прандиальным регулятором является инсулин короткого действия. Подкожное введение препаратов инсулина короткого действия перед приемом пищи позволяет предупредить резкий подъем уровня глюкозы после еды.
Выше мы уже упоминали о пересмотре показаний к инсулинотерапии при СД 2 типа, точнее говоря, о необходимости их расширения. Как правило, необходимость в инсулинотерапии прямо пропорциональна длительности диабета; по некоторым данным, через 10–12 лет после дебюта заболевания в подобном лечении нуждаются почти 80% больных. Многие пациенты, нуждающиеся в инсулинотерапии, но не являющиеся кандидатами на проведение интенсивной инсулинотерапии, могут достичь хорошей компенсации благодаря двухразовой базис-болюсной схеме.
В подобных случаях следует отдавать предпочтение готовой смеси инсулина в пропорции 30 : 70. Использование подобной готовой смеси инсулина обеспечивает рациональную и «физиологическую» пропорцию инсулина короткого действия (1 : 3) и средней продолжительности действия (2 : 3), которая покрывает потребность как в «болюсном», так и «базисном» инсулине у больных СД 2 типа.
Использование готовой смеси в пропорции 30 : 70, вводимой с помощью щприц-ручки, представляется рациональным, особенно для пожилых пациентов с СД 2 типа. Такой инсулин обладает преимуществом перед базисным инсулином, так как лечения только базальным инсулином, при отсутствии короткого, недостаточно для эффективного контроля гликемии после приема пищи. Терапия готовыми смесями в пропорции 30 : 70 начинается с суточной дозы 0,4–0,6 ЕД/кг массы тела, обычно разделенной поровну на 2 инъекции — перед завтраком и ужином, у части пациентов 2 : 3 суточной дозы назначается перед завтраком и 1 : 3 — перед ужином. Далее доза инсулина при необходимости постепенно увеличивается каждые 2–4 дня на 4–6 ЕД, до достижения целевых уровней контроля.
Побочные эффекты инсулинотерапии включают прибавку в весе, что также характерно для всех сахароснижающих препаратов, за исключением метформина, и гипогликемии. Повышение массы тела, наблюдаемое у больных СД 2 типа, находящихся на инсулинотерапии, обусловлено в первую очередь устранением последствий хронической гипергликемии: глюкозурии, дегидратации, энергозатрат. Среди других причин — восстановление положительного азотистого баланса, а также повышение аппетита. В начале терапии потребность в более высокой дозе инсулина у части больных обусловлена выраженной инсулинорезистентностью. Методы профилактики увеличения массы тела у больных СД 2 типа, находящихся на инсулинотерапии, включают обучение пациентов, ведение пищевого дневника, снижение калорийности рациона, ограничение употребления поваренной соли и повышение физической активности.
Значительным преимуществом в плане ограничения увеличения массы тела у больных СД типа 2 с избыточным весом обладает комбинированная терапия инсулином и метформином, для которой характерны не только дополнительное снижение гликемии натощак, но и уменьшение потребности в экзогенном инсулине (17–30%), а также низкий риск гипогликемий, липопротективный эффект.
Тяжелые гипогликемии отмечаются значительно реже у больных СД 2 типа, находящихся на инсулинотерапии, в сравнении с пациентами на интенсивной инсулинотерапии при СД 1 типа. Они гораздо чаще возникают и в ряде случаев имеют рецидивирующее течение при лечении СД 2 типа некоторыми производными сульфонилмочевины длительного действия, нежели при терапии инсулином.
Главным критерием адекватности дозы инсулина у больных СД 2 типа является уровень гликемии. В начале инсулинотерапии для достижения компенсации СД могут потребоваться бoльшие дозы инсулина, что в основном обусловлено снижением чувствительности к инсулину вследствие хронической гипергликемии и инсулинорезистентностью. При достижении нормогликемии потребность в инсулине уменьшается.
Раннее и обоснованное назначение инсулинотерапии является основным фактором, способствующим длительному поддержанию целевых уровней гликемии.
Прогрессирующее ухудшение метаболического статуса и толерантность к улучшению функции β-клеток обосновывают более агрессивную тактику лечения СД 2 типа, оправданную уже на ранних стадиях заболевания. Своевременная и адекватная инсулинотерапия в виде монотерапии или в комбинации с таблетированными сахароснижающими препаратами у больных СД 2 типа открывают широкие перспективы достижения основных целей лечения СД — поддержания долгосрочного метаболического контроля и предотвращения или отсрочки сосудистых осложнений.
По вопросам литературы обращайтесь в редакцию.
А. М. Мкртумян, доктор медицинских наук, профессор
Е. В. Бирюкова, кандидат медицинских наук, доцент
Н. В. Маркина
МГМСУ, Москва
