ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ САХАРНОГО ДИАБЕТА
Метаболическая хирургия, или хирургия ожирения, у лиц с СД ставит целью не просто уменьшить массу тела пациента, но также добиться благоприятных метаболических эффектов (нормализации гликемии, липидного обмена).
- Метаболическая хирургия рекомендуется для лечения СД 2 типа у взрослых пациентов с ИМТ ≥ 35 кг/м2 (≥ 32,5 кг/м2 для азиатской популяции), не достигших контроля гликемии после нескольких попыток нехирургического лечения ожирения (изменения образа жизни и медикаментозной терапии). Метаболическая хирургия может рассматриваться у лиц с ИМТ ≥ 30 кг/м2 (≥ 27,5 кг/м2 для азиатской популяции), не достигших снижения массы тела и контроля гликемии на фоне нехирургического лечения (УУР А, УДД 1).
- Метаболические хирургические операции рекомендовано выполнять квалифицированным хирургам, имеющими большой опыт в выполнении таких операций. Решение о проведении операции должно основываться на мнении мультидисциплинарной команды, включающей эндокринолога, хирурга, терапевта/кардиолога, диетолога, психиатра, при необходимости — других специалистов (УУР С, УДД 4).
- Хирургическое лечение СД 1 типа не рекомендовано, за исключением пациентов с ИМТ ≥ 40 кг/м2 (УУР В, УДД 3).
- Метаболическая хирургия не рекомендована лицам с обострением язвенной болезни желудка и двенадцатиперстной кишки; онкологическими заболеваниями, продолжительность ремиссии которых после лечения составляет менее 5 лет; психическими расстройствами: тяжелыми депрессиями, психозами (в том числе, хроническими), злоупотреблением психоактивными веществами (алкоголем, наркотическими и иными психотропными), некоторыми видами расстройств личности (психопатиями); заболеваниями, угрожающими жизни в ближайшее время, тяжелыми необратимыми изменениями со стороны жизненно важных органов (ХСН III-IV функциональных классов, печеночная, почечная недостаточность и др.); беременным женщинам (УУР С, УДД 4).
- В раннем послеоперационном периоде рекомендуется частый мониторинг гликемии – не менее 4 раз в сутки. При возникновении гипогликемии на фоне исходной сахароснижающей рекомендуется постепенная отмена препаратов (УУР В, УДД 3).
- В послеоперационном периоде рекомендуется длительное, часто пожизненное наблюдение с определением статуса усвоения макро- и микронутриентов. При необходимости рекомендовано восполнение дефицита витаминов/нутриентов (УУР В, УДД 3).
Цель метаболической хирургии – достижение целевых уровней гликемического контроля, вплоть до ремиссии СД 2 типа. Частота достижения и длительность ремиссии СД 2 типа зависит от вида бариатрической операции (наибольшей эффективностью обладают шунтирующие операции).
Определение ремиссии СД 2 типа:
- поддержание уровня HbA1c<6,5%;
поддержание уровня глюкозы плазмы натощак 6,1–6,9 ммоль/л на протяжении, по крайней мере, 1 года после операции в отсутствие фармакотерапии; - поддержание уровня HbA1c<6,5%;
- поддержание уровня глюкозы плазмы натощак 6,1–6,9 ммоль/л на протяжении, по крайней мере, 1 года после операции в отсутствие фармакотерапии;
- поддержание уровня HbA1c<6,0%;
поддержание уровня глюкозы плазмы натощак <6,1 ммоль/л на протяжении, по крайней мере, 1 года после операции в отсутствие фармакотерапии; - поддержание уровня HbA1c<6,0%;
- поддержание уровня глюкозы плазмы натощак <6,1 ммоль/л на протяжении, по крайней мере, 1 года после операции в отсутствие фармакотерапии;
- наличие полной ремиссии на протяжении 5 лет наблюдения.
Послеоперационное наблюдение
Прогноз при своевременной помощи пациенту с легкой гипогликемией благоприятный. В случае тяжёлой гипогликемии всё зависит от того, в какой стадии комы находился человек и развились ли у него осложнения.
Профилактика гипогликемической комы:
- Всегда иметь при себе быстроусвояемые углеводы не менее 2 ХЕ (хлебных единиц), например леденец, кусочек сахара или глюкозу.
- При незапланированной физической нагрузке обязательно принимать дополнительные углеводы (1-2 ХЕ).
- Перед походом в спортзал необходимо скорректировать инсулин и, если требуется, принять дополнительное количество углеводов в зависимости от уровня гликемии.
При возникновении лёгкой гипогликемии необходимо съесть 4 куска или 4 чайные ложки сахара (2 ХЕ), также допустим приём углеводов в жидкой форме (200 г сладкого сока или чая). Если гипогликемия вызвана приёмом большой дозы инсулина, то необходимо съесть 2 ХЕ быстрых углеводов (например кусок хлеба).
Для профилактики кетоацидоза важно постоянно контролировать глюкозу в крови, при необходимости корректировать дозу инсулина, проверять его сроки годности и хранить в прохладном месте. Также важно менять иголку в шприце-ручке и места инъекций (чтобы не допустить истончения жировой ткани). При ОРВИ возможно потребуется увеличение дозы инсулина. Нельзя сидеть на безуглеводных диетах.
STANDARDS OF SPECIALIZED DIABETES CARE
Edited by Dedov I.I., Shestakova M.V., Mayorov A.Yu.
9th Edition (revised)
Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. – 9-й выпуск (дополненный). – М.; 2019.
Данное издание содержит девятый актуализированный выпуск (дополненный) клинических рекомендаций по стандартизации и оптимизации оказания медицинской помощи больным сахарным диабетом во всех регионах России на основе доказательной медицины. Издание содержит обновленную информацию в соответствии с новыми данными и рекомендациями по лечению больных сахарным диабетом, а также рандомизированных клинических испытаний. В новом издании сохранен акцент на персонифицированный артериального давления, обновлены позиции, касающиеся выбора сахароснижающих препаратов при лечении сахарного диабета 2 типа, бариатрической хирургии как метода лечения сахарного диабета с морбидным ожирением. Появилась информация о непрерывном мониторировании глюкозы, психосоциальной поддержке, синдроме гипогонадизма у мужчин с сахарным диабетом. Впервые приведены уровни достоверности доказательств и уровни убедительности рекомендаций для диагностических, лечебных, реабилитационных и профилактических вмешательств, основанные на систематическом обзоре литературы, в соответствии с рекомендациями Минздрава России.
Издание предназначено для практикующих врачей эндокринологов, терапевтов, врачей общей практики, педиатров и специалистов смежных специальностей, а также интернов, ординаторов и аспирантов соответствующих направлений.
Права на данное издание принадлежат коллективу авторов, а также организациям-разработчикам: ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, ОО «Российская ассоциация эндокринологов». Воспроизведение и распространение в каком-бы то ни было виде части или целого издания не могут быть осуществлены без письменного разрешения правообладателей.
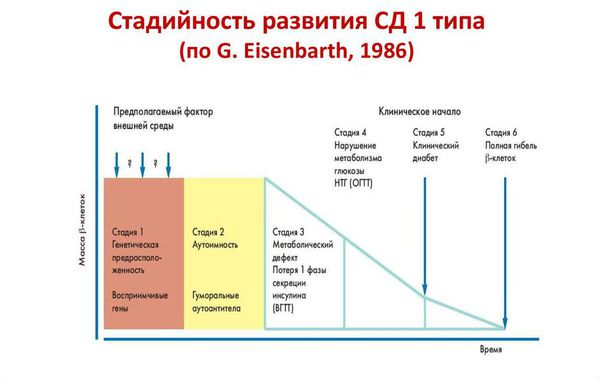
Классификация и стадии развития сахарного диабета 1 типа
- Первичный сахарный диабет: генетически обусловленный, эссенциальный (врождённый) с ожирением или без него.
- Вторичный сахарный диабет (симптоматический): гипофизарный, стероидный, тиреоидный, адреналовый, панкреатический, бронзовый. Данный вид встречается на фоне другой клинической патологии, которая может и не сочетаться с сахарным диабетом.
Стадии развития сахарного диабета 1 типа:
- Генетическая предрасположенность к диабету. 95 % больных имеет генетическую предрасположенность.
- Гипотетический пусковой момент. Повреждение бета-клеток разными диабетогенными факторами и триггирование иммунных процессов (запуск неправильной иммунной реакции).
- Активный аутоиммунный инсулит (происходит когда титр антител высокий, количество бета-клеток уменьшается, секреция инсулина снижается).
- Снижение стимулированной глюкозой секреции инсулина. При стрессе у пациента может быть преходящее нарушение толерантности (переносимости) к глюкозе (НТГ) и нарушение гликемии натощак (НГН).
- Проявление клинических симптомов диабета, с возможным эпизодом «медового месяца». Это сравнительно недолгий период времени у людей с сахарным диабетом 1 типа, при котором значительно снижается или даже полностью отсутствует потребность в инъекциях инсулина.
САХАРНЫЙ ДИАБЕТ У ДЕТЕЙ И ПОДРОСТКОВ
1 Нормальный уровень в соответствии со стандартами DCCT: до 6%
2 Целевые уровни глюкозы крови и НbА1с должны быть индивидуализированы для каждого пациента:
- Более низкий уровень НbА1с (< 6,5%) допустим только при отсутствии необоснованного риска тяжелой гипогликемии, частых эпизодов легкой гипогликемии и снижения качества жизни ребенка и родителей;
- Более высокий уровень НbА1с (< 7,5%) целесообразен у детей, которые не могут сообщить о симптомах гипогликемии, с нарушением восприятия гипогликемии/тяжелой гипогликемией в анамнезе, недостаточным контролем уровня глюкозы крови.
Примечание: Необходимыми условиями достижения целевого уровня гликемического контроля являются:
- Регулярный контроль НbА1с;
- Использование непрерывного мониторирования глюкозы или регулярный самоконтроль гликемии 6-10 раз в сутки;
- Регулярная оценка и коррекция лечения.
Рекомендации по мониторингу контроля углеводного обмена (ISPAD, 2018)
- Пациентам, находящимся на интенсифицированной инсулинотерапии или на терапии с помощью инсулиновой помпы, рекомендуется проводить исследование гликемии от 6 до 10 раз в сутки (УУР В, УДД 3).
- Количество исследований может повышаться при подборе дозы инсулина у пациентов с недостижением целевых уровней гликемического контроля, при стрессах, интеркуррентных заболеваниях и физических нагрузках.
- Исследование кетоновых тел в крови или моче должно проводиться при заболеваниях с повышением температуры и/или рвотой, при плохом самочувствии и уровне ГП выше 14 ммоль/л, особенно при помповой инсулинотерапии, полиурии, сонливости, болях в животе, одышке.
- Частота проведения анализов на HbA1c составляет минимум 1 раз в 3 мес (УУР А, УДД 3).
Рекомендации по питанию
Суточное количество ХЕ индивидуально, зависит от возраста и пола ребенка, с учетом индекса массы тела, образа жизни (ниже представлены средние значения):
- 4 – 6 лет 12 – 13 ХЕ
- 7 – 10 лет 15 – 16 ХЕ
- 11 – 14 лет 18 – 20 ХЕ (мальчики), 16 – 17 ХЕ (девочки)
- 15 – 18 лет 19 – 21 ХЕ (мальчики), 17 – 18 ХЕ (девочки)
У подростков с избыточной массой тела количество ХЕ должно быть ниже рекомендуемых по возрасту.
Потребность в инсулине в детском возрасте
Лечение следует проводить в центрах, имеющих опыт работы с ДКА у детей и подростков, и где могут регулярно проверять показатели жизненно важных функций, неврологический статус и лабораторные результаты. Если для этого имеются географические ограничения, до перевода в специализированный центр следует организовать телефонную связь с врачом, обладающим экспертными знаниями в области ДКА.
Возмещение жидкости следует начать до инсулиновой терапии. По необходимости расширяют объем для восстановления периферической циркуляции. Рассчитывают дальнейшую норму приема жидкости, включая обеспечение дневной потребности в жидкости, стремясь равномерно восполнить предполагаемый дефицит жидкости за 48 ч.
Норма приема жидкости обычно не должна превышать дневную норму при поддержании более чем в 1,5–2 раза. Суточная физиологическая потребность зависит от возраста ребенка и составляет:
- в возрасте до 1 года – 120-140 мл/кг
- в возрасте 2 лет – 115-125 мл/кг
- в возрасте 5 лет – 90-100 мл/кг
- в возрасте 10 лет – 70-85 мл/кг
- в возрасте 14 лет – 50-60 мл/кг
- в возрасте 18 лет – 40-50 мл/кг.
Упрощенное количество вводимой при ДКА жидкости составляет: при весе ребенка менее 10 кг – 4 мл/ кг/ч, при весе ребенка 11-20 кг – 40 мл/ч+2 мл/кг/ч, при весе ребенка более 20 кг – 60 мл/ч+1 мл/кг/ч. К рассчитанной физиологической потребности в зависимости от степени дегидратации добавляют 25-50 мл/кг/ сут. В первые 8 ч вводится примерно 50% рассчитанного объема, оставшиеся 50% — в течение остальных 16 ч.
Инсулинотерапию начинают с 0,05–0,1 ед/кг/ч в течение 1–2 ч после начала терапии возмещения жидкости, до разрешения ДКА, с последующей коррекций.
Во время первоначального восполнения объема уровень ГП резко снижается. После начала инсулинотерапии концентрация ГП обычно снижается со скоростью 2–5 ммоль/л в час в зависимости от времени и количества назначаемой глюкозы.
Калий. Если у пациента наблюдается гипокалиемия, необходимо задержать возмещающую терапию калия до тех пор, пока не появится диурез. В противном случае, начинают с концентрации калия 40 ммоль/л для пациентов, получающих жидкость в объеме более 10 мл/кг/ч.
Введение бикарбоната не рекомендуется, за исключением лечения гиперкалиемии, угрожающей жизни.
Отек головного мозга – грозное осложнение ДКА. Распространенность составляет 0,5–0,9%, показатель смертности — 21–24%. Редко проявляется позже подросткового возраста. Возможные ФР развития отека мозга при диагностике или при терапии ДКА:
- выраженная гиперкапния при первичном осмотре после определения степени ацидоза;
- повышенный уровень мочевины при первичном обследовании;
- тяжелый ацидоз при первичном обследовании;
- терапия бикарбонатом для коррекции ацидоза;
- быстрое снижение эффективной осмолярности плазмы;
- затухающее повышение измеренного уровня натрия плазмы или раннее снижение натрия, скорректированного глюкозой, в ходе терапии;
- большие объемы жидкости, назначаемые в первые 4 ч;
- инсулинотерапия в течение первого часа инфузионной терапии.
Признаки и симптомы отека головного мозга
- Головные боли и замедление частоты сердечных сокращений.
- Изменения неврологического статуса (беспокойство, раздражительность, повышенная сонливость, недержание мочи).
- Специфические неврологические признаки (например, парезы черепно-мозговых нервов).
- Снижение насыщения O2.
Лечение отека головного мозга начинают, как только возникнут подозрения на его развитие.
- Уменьшают скорость введения жидкостей на треть.
- Вводят маннитол в дозе 0,5–1,0 г/кг в/в в течение 10–15 мин и повторяют назначение, если нет ответной реакции в период от 30 мин до 2 ч.
- Гипертонический солевой раствор (3%) в дозе 2,5–5,0 мл/кг в течение
10–15 мин может быть альтернативой маннитолу, если нет первичной ответной реакции на маннитол. - Гиперосмолярные агенты должны быть доступны у постели больного.
- Необходимо приподнять изголовье кровати до 30°.
- Интубация может быть необходима для пациентов с угрозой дыхательной недостаточности.
- После начала терапии отека головного мозга провести компьютерную томографию для исключения состояний, требующие срочной нейрохирургической операции (внутричерепное кровотечение, церебро-васкулярный тромбоз и пр.).
Особенности осложнений СД 1 типа у детей и подростков
Ретинопатия – проводится ежегодно, начиная с возраста 11 лет при длительности заболевания более 2 лет (УУР А, УДД 2).
Нефропатия – проводится ежегодно, начиная с возраста 11 лет при длительности заболевания более 2 лет (УУР В, УДД 2).
Нейропатия – проводится ежегодно, начиная с возраста 11 лет при длительности заболевания более 2 лет (УУР В, УДД 3).
Макроангиопатия – липидный профиль при диагностике СД, затем каждые 2 года с возраста 11 лет (УУР В, УДД 3), АД – ежегодно (УУР В, УДД 2).
При появлении МАУ – исключить заболевания/состояния, которые могут быть причиной появления белка в моче:
- декомпенсация СД с кетозом,
- инфекция мочевыводящих путей,
- интенсивная физическая нагрузка,
- повышенная подвижность почек,
- ортостатическая протеинурия (отмечается у подростков в период интенсивного роста; исключается путем определения протеинурии в моче, собранной отдельно в дневные и ночные часы, причем в ночное время – строго в положении лежа).
Ограниченная подвижность суставов (ОПС), или хайропатия
- ОПС – двусторонние безболезненные контрактуры суставов, в первую очередь кистей рук, при прогрессировании – лучезапястных, локтевых суставов, шейного отдела позвоночника и др.
- В основе развития ОПС лежит избыточное гликирование коллагена.
- Наблюдается у длительно декомпенсированных больных, часто – в сочетании с другими осложнениями
- СД, в том числе с задержкой физического развития и катарактой.
- Диагностика: визуальная – путем складывания кистей рук ладонной поверхностью внутрь.
- Методы терапии отсутствуют.
НЕИММУННЫЕ ФОРМЫ СД
Неиммунные формы СД («СД не 1 типа») могут составлять до 10 % всех случаев СД у детей и подростков:
- СД 2 типа;
- МОDY (СД «зрелого типа» у молодых);
- СД, ассоциированный с генетическими синдромами (DIDMOAD, синдром Альстрема, синдром Прадера-Вилли и др).
Возможность других типов СД следует рассмотреть у ребенка, не имеющего аутоантител, ассоциированных с СД 1 типа в следующих случаях (УУР В, УДД 2):
- аутосомно-доминантный семейный анамнез диабета (MODY)
- возраст менее 12 месяцев и особенно в первые 6 месяцев жизни (неонатальный СД)
- гипергликемия натощак 6,1-8,5 ммоль, особенно при отсутствии симптомов СД
- длительный медовый месяц более 1 года или необычно низкая потребность в инсулине (≤0.5 ЕД/кг/сутки) при длительности СД более 1 года
- ассоциированные заболевания, такие как глухота, оптическая атрофия, или другие синдромальные особенности (митохондриальная болезнь)
- в анамнезе применение препаратов с известной токсичностью для β-клеток или вызывающие инсулинорезистентность причины (например, иммуносупрессивные препараты такие как акролимус, циклоспорин; глюокортикоиды или некоторые антидепрессанты).
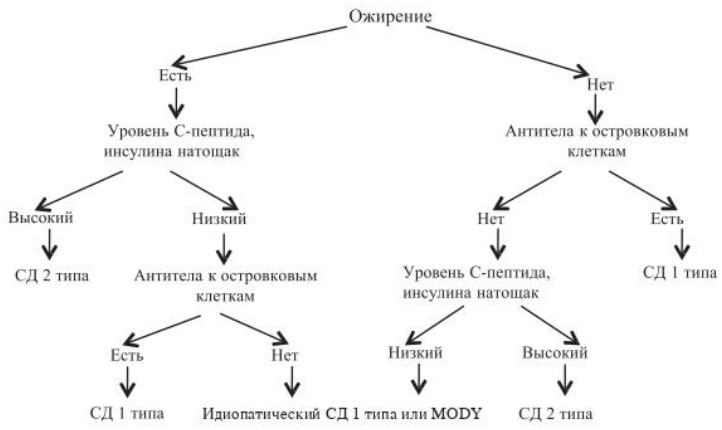
Алгоритм лечения дифференциальной диагностики СД у детей и подростков
СД 2 типа
- У большинства больных начало бессимптомное или малосимптомное.
- У 5–25 % подростков, которые впоследствии классифицируются как СД 2 типа, в начале заболевания имеется выраженный дефицит инсулина из-за глюко- и липотоксичности.
- У части больных СД 2 типа могут иметься аутоантитела, характерные для СД 1 типа.
- У 30–40 % подростков СД 2 типа манифестирует с кетозом, в отдельных случаях – с гиперосмолярным гипергликемическим состоянием.
Диагностические критерии гипергликемического гиперосмолярного состояния
- глюкоза плазмы ≥ 33 ммоль/л;
- осмолярность плазмы ≥ 330 мосм/л;
- умеренный ацидоз – бикарбонаты ≥ 15 ммоль/л;
- незначительная кетонурия ≤ 1,5 ммоль/л.
Все случаи СД у детей и подростков с ожирением, в том числе и при острой манифестации, требуют исключения СД 2 типа.
СД 2 типа вероятен при наличии следующих признаков:
- возраст ребенка старше 10 лет;
- случаи СД 2 типа в семейном анамнезе;
- расовая или этническая группа высокого риска;
- отсутствие панкреатических аутоантител;
- нормальный или высокий уровень С-пептида;
Определение инсулинорезистентности проводится с учетом концентрации иммунореактивного инсулина (ИРИ) и уровня глюкозы плазмы (ГП) натощак и в ходе ПГТТ
Скрининг детей на СД 2 типа
- Может возникать временная потребность в инсулине на фоне стрессов и интеркуррентных заболеваний.
- Рано возникает инсулинозависимость.
- Характерны ранние микро- и макрососудистые осложнения, в том числе уже при манифестации заболевания.
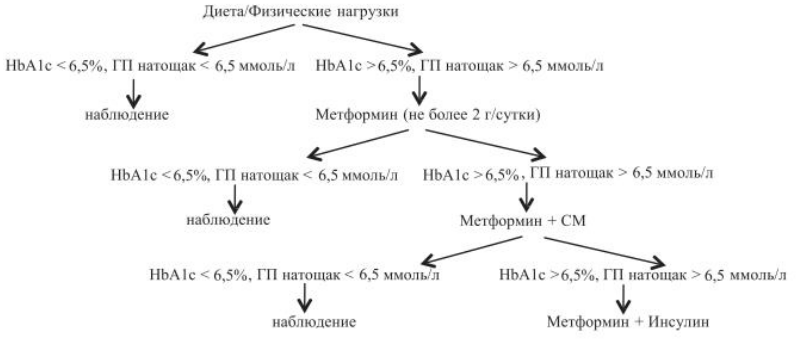
Лечение СД 2 типа у детей и подростков
- Самоконтроль гликемии должен включать определение уровня ГП как натощак, так и постпрандиально, а частота определения зависит от вида сахароснижающей терапии и степени достижения целевого уровня гликемического контроля:
- на интенсифицированной инсулинотерапии: от 6 до 10 раз в сутки;
- на пероральной сахароснижающей терапии и/или базальном инсулине: не менее 1 раза в сутки в разное время + 1 гликемический профиль (не менее
4 раз в сутки) в неделю; - количество исследований может повышаться у пациентов с недостижением целевых уровней гликемического контроля, при стрессах, интеркуррентных заболеваниях и физических нагрузках.
- Уровень HbA1c определяется минимум 1 раз в 3 мес.
Тестирование на сопутствующие заболевания и осложнения
- Микро- и макроальбуминурия, консультация окулиста, установление неалкогольной жировой дистрофии печени – при установлении диагноза и впоследствии ежегодно.
- Контроль АД – при установлении диагноза АГ и при каждом последующем визите.
- Дислипидемия исследуется при установлении диагноза, скрининг проводится после стабилизации метаболических показателей.
- Анализ течения пубертата, менструальных нарушений и наличия обструктивного апноэ во сне – при установлении пубертата и регулярно впоследствии.
Моногенные формы СД
- начало в молодом возрасте (до 25 лет);
- мягкое течение, не требующее инсулинотерапии или с небольшой потребностью в инсулине, в большинстве случаев высокая чувствительность к препаратам СМ;
- наличие как минимум 14 подтипов MODY, различающихся клинически и генетически;
MODY должен быть заподозрен:
- у не страдающих ожирением пациентов;
- при развитии СД до 25 лет;
- при наличии СД в родословной данной семьи в двух или трех поколениях.
MODY представляет собой моногенную форму СД или нарушения углеводного обмена, которая характеризуется ранним началом, аутосомно-доминантным способом наследования, мягким, в большинстве случаем, течением, и, как правило, первичным дефектом функции β-клеток поджелудочной железы. К настоящему времени идентифицировано более 14 генов MODY, которые не описывают все случаи, клинически похожие на MODY. Таким образом, существуют еще неизвестные гены, приводящие к развитию MODY, и их еще предстоит идентифицировать. Мутации в генах GCK (MODY2), HNF1A (MODY3), HNF4A (MODY1) являются наиболее частыми причинами MODY.
Жалобы при GCK-MODY обычно отсутствуют, диагностика случайная, заболевание проявляется как умеренная гипергликемия натощак (от 6,1 до 8,0 ммоль/л, HbA1c в диапазоне от 5,8 до 7,6%, которые могут выявляться с рождения, в дальнейшем отмечается небольшое прогрессирование заболевания. Выраженная гипергликемия и микрососудистые осложнения встречаются крайне редко. Терапия в основном заключается в соблюдении диеты с ограничением легкоусвояемых углеводов, а также достаточных физических нагрузках. Осложнения СД развиваются крайне редко, поэтому медикаментозная терапия назначается в 6-12% случаев, как правило, в пожилом возрасте в связи с невозможностью соблюдать активный образ жизни. Терапия необходима во время беременности в связи с возможным развитием диабетической фетопатии у плода.
Пациенты с мутацией HNF-1α (MODY3) обычно имеют нормогликемию до подросткового возраста. Характерно развитие глюкозурии еще до нарушения углеводного обмена, что связано со снижением реабсорбции глюкозы в почках. В дальнейшем появляется постпрандиальная гипергликемия. При проведении ПГТТ уровень глюкозы плазмы через 2 часа может быть 12,0 ммоль/л и выше, даже если уровень глюкозы плазмы натощак был в пределах нормы. Описаны единичные случаи развития кетоацидоза во взрослом возрасте. Риски микрососудистых и макрососудистых осложнений сходны с таковыми при СД 1 и 2 типов. Для лечения в первую очередь используются препараты сульфонилмочевины (ПСМ), что обусловлено их высокой чувствительностью к данной терапии. Причем пациенты могут безопасно переходить с инсулинотерапии на ПСМ. Через 25-35 лет от манифестации заболевания большинство пациентов вынуждено переходить на инсулинотерапию в связи с прогрессирующей недостаточностью бета-клеток.
Дифференциальный диагноз между СД 1 и 2 типа, моногенным СД и другими формами СД имеет принципиальное значение для выбора соответствующего патогенетического метода терапии, особенностей обучения, прогноза течения заболевания. Диагностические инструменты, которые могут помочь в подтверждении типа СД, если диагноз неясен, включают в себя:
Ассоциированные с СД 1 типа аутоантитела: антитела к глютаматдекарбоксилазе (GADА); к тирозинфосфатазе (IA2); инсулиновые аутоантитела (IAA); и специфические для бета-клеток аутоантитела к транспортеру 8 цинка (ZnT8А). Наличие одного из этих антител подтверждает диагноз СД 1 типа (УУР А, УДД 1).
Молекулярно-генетическое исследование может помочь в верификации диагноза и выборе метода терапии у детей, подозрительных на наличие моногенного СД (УУР В, УДД 2).
Неонатальный СД (НСД)
- Транзиторный: потребность в инсулине исчезает спустя несколько месяцев от манифестации, рецидивы возникают в дальнейшем в 50 % случаев.
- Перманентный: перерыва в потребности в инсулинотерапии не наблюдается.
НСД может быть компонентом ряда генетических синдромов (IPEX-синдром, синдром Уолкотт–Роллисона, НСД в сочетании с аплазией или гипоплазией поджелудочной железы, некоторые подтипы MODY и др.).
При НСД обнаруживается множество мутаций генов, наибольшее практическое значение из которых имеет мутация в генах KCNI11 и АВСС8, кодирующих Kir 6.2 и SUR1-субъединицы АТФ-зависимых калиевых каналов, поскольку до 90 % пациентов с этими мутациями могут быть успешно переведены с инсулина на ПСМ, независимо от длительности СД.
НСД вероятен в следующих случаях:
- СД у новорожденных или в возрасте до 6 мес;
- семейная форма СД с поражением одного из родителей;
- умеренное повышение глюкозы плазмы натощак (5,5–8,5 ммоль/л), особенно при семейной форме СД;
- низкая потребность в инсулине вне ремиссии, возможность обходиться без инсулина либо выраженная инсулинорезистентность;
- наличие экстрапанкреатических заболеваний (тугоухость, атрофия диска зрительного нерва, пигментная дегенерация сетчатки, заболевания печени, почек, атаксия и т. д.).
Наиболее часто встречающиеся генетические синдромы, связанные с СД
Примечания: АРН – аутосомно-рецессивное наследование; АДН – аутосомно- доминантное наследование; ЦНС – центральная нервная система; СПЯ – синдром поликистоза яичников.
Благодаря успехам молекулярной генетики были идентифицированы гены, связанные со многими клиническими подгруппами СД. Это объясняет клиническую гетерогенность течения заболевания, сроков диагностики, например, неонатальный СД и MODY. В настоящее время для диагностики моногенных форм СД используются молекулярно-генетические исследования, что дает возможность точно верифицировать заболевание и лечение детей с СД. В связи с высокой стоимостью таких исследований их следует применять для диагностики больных, клиника которых дает основание подозревать моногенную форму СД.
МЕДИКО-ГЕНЕТИЧЕСКОЕ КОНСУЛЬТИРОВАНИЕ СЕМЕЙ БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ
СД относится к заболеваниям с наследственной предрасположенностью. По наследству передается предрасположенность к тому же типу СД, что и у пробанда. Здоровые родственники должны быть информированы о риске развития заболевания у них.
Эмпирический риск развития СД 1 типа для родственников больных СД 1 типа
Ступенчатый комплексный анализ молекулярно-генетических, иммунологических и гормонально-метаболических маркеров СД 1 типа позволяет оценить риск заболевания с вероятностью более 90 %.
ПЕРЕХОД ПАЦИЕНТА С СД ИЗ ПЕДИАТРИЧЕСКОЙ ВО ВЗРОСЛУЮ МЕДИЦИНСКУЮ СЛУЖБУ
Подростковый период – переходная фаза развития между детством и взрослой жизнью, которая включает биологические и психосоциальные изменения, свойственные пубертату. В подростковом возрасте начинается период формирования независимого взрослого, и это может приводить как к успеху, так и к неудачам и ошибкам. Должен быть рассмотрен запланированный, целенаправленный переход подростка или молодого человека с хроническим заболеванием из медицинской системы, ориентированной на лечение детей (и семей), в медицинскую систему здравоохранения, ориентированную на помощь взрослым (УУР С, УДД 3). Обеспечение плавного перехода от педиатрической медицинской помощи к медицинской помощи взрослым должно происходить в наиболее подходящее время (УУР С, УДД 5). Официально переход из педиатрической и подростковой медицинской службы в Российской Федерации происходит в 18 лет.
Необходимо обеспечить помощь родителям с учетом изменений их роли от полной ответственности за ребенка до постепенного перехода к самостоятельному ведению заболевания самим молодым человеком.
Есть потенциальная опасность, что при переходе во взрослую сеть молодые люди могут быть потеряны для наблюдения и прекратят регулярно посещать специализированные службы. Это с большой вероятностью приводит к плохой приверженности терапии и повышению риска острых и хронических осложнений СД, включая увеличение смертности.
Для успешного перехода в систему здравоохранения взрослых необходимо рассмотреть следующие шаги:
- Выявление взрослой службы (конкретное лечебное учреждение и врач- эндокринолог), которая сможет обеспечить потребности молодого взрослого с СД.
- Должен быть налажен контакт между педиатрической и взрослой медицинскими службами, который может помочь переходу молодого человека во взрослую службу, заранее, до достижения 18 лет. В частности, необходимо разработать четкий, документированный план для перехода, подготовлен медицинский эпикриз подростка, включая показатели контроля, результаты скрининга на осложнения и информацию по каким-либо сопутствующим заболеваниям, которые могут повлиять на дальнейшее ведение пациента.
- Надо добиться того, чтобы не было существенного промежутка в предоставлении медицинской помощи, когда пациент оставляет педиатрическую медицинскую службу и попадает во взрослую систему, таким образом, чтобы подросток не был потерян для дальнейшего динамического наблюдения.
- Взрослая медицинская служба должна быть построена таким образом, чтобы обеспечивать длительное динамическое наблюдение и оценку показателей конечных исходов у лиц с развитием СД в детском и подростковом возрасте, так как у них чаще наблюдается неудовлетворительный гликемический контроль и чаще развиваются осложнения.
- Современные технологии (помповая инсулинотерапия, непрерывное мониторирование глюкозы), а также дистанционное консультирование могут улучшить приверженность молодых людей к лечению (УУР В, УДД 2).
- Необходимо дать советы по трудовой карьере в областях, которые могут подходить и не подходить для людей с СД (УУР С, УДД 5). Благоприятное медицинское заключение от врачей может убедить работодателей в том, что наличие болезни не должно быть проблемой при устройстве на работу.
- Обеспечение специфической информацией (контрацепция и беременность, вождение автомобиля, вред от употребления алкоголя, наркотических препаратов, курения) приобретают все большее значение по мере того, как растет независимость подростка от семьи, особенно когда ему приходится жить далеко от дома в связи с работой, обучением в колледже или университете (УУР С, УДД 5).
Успешный переход от педиатрической к взрослой службе может иметь такое же большое значение для качества жизни молодых людей, как и специфическое лечение СД.
АЛГОРИТМЫ СПЕЦИАЛИЗИРОВАННОЙ МЕДИЦИНСКОЙ ПОМОЩИ БОЛЬНЫМ САХАРНЫМ ДИАБЕТОМ
Министерство здравоохранения Российской Федерации
ДИАГНОСТИКА САХАРНОГО ДИАБЕТА
Перевод глюкозы крови из ммоль/л в мг/дл:
ммоль/л × 18,02 = мг/дл
Натощак – означает уровень глюкозы крови утром после предварительного голодания в течение не менее 8 часов и не более 14 часов.
Случайное – означает уровень глюкозы крови в любое время суток вне зависимости от времени приема пищи.
ПГТТ – пероральный глюкозотолерантный тест. Проводится в случае сомнительных значений гликемии для уточнения диагноза.
Правила проведения ПГТТ:
ПГТТ следует проводить утром на фоне не менее чем 3-дневного неограниченного питания (более 150 г углеводов в сутки) и обычной физической активности. Тесту должно предшествовать ночное голодание в течение 8–14 часов (можно пить воду). Последний вечерний прием пищи должен содержать 30–50 г углеводов. После забора крови натощак испытуемый должен не более чем за 5 мин выпить 75 г безводной глюкозы или 82,5 г моногидрата глюкозы, растворенных в 250–300 мл воды. Для детей нагрузка составляет 1,75 г безводной глюкозы (или 1,925 г моногидрата глюкозы) на кг массы тела, но не более 75 г (82,5 г). В процессе теста не разрешается курение. Через 2 часа осуществляется повторный забор крови.
Для предотвращения гликолиза и ошибочных результатов определение концентрации глюкозы проводится сразу после взятия крови, или кровь должна быть центрифугирована сразу после взятия, или храниться при температуре 0–4°С, или быть взята в пробирку с консервантом (флуорид натрия).
ПГТТ не проводится:
- на фоне острого заболевания
- на фоне кратковременного приема препаратов, повышающих уровень гликемии (глюкокортикоиды, тиреоидные гормоны, тиазиды, бета-адреноблокаторы и др.)
НbA1с КАК ДИАГНОСТИЧЕСКИЙ КРИТЕРИЙ СД
В 2011 г. ВОЗ одобрила возможность использования HbA1c для диагностики СД.
В качестве диагностического критерия СД выбран уровень HbA1c ≥6,5 % (48 ммоль/моль).
Исследование должно быть выполнено с использованием метода определения HbA1c, сертифицированного в соответствии с National Glycohemoglobin Standardization Program (NGSP) или International Federation of Clinical Chemists (IFCC) и стандартизованного в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial (DCCT). Нормальным считается уровень HbA1c до 6,0 % (42 ммоль/моль). Согласно рекомендациям ВОЗ, уровень HbA1c 6,0-6,4% (42-47 ммоль/моль) сам по себе не позволяет ставить какие-либо диагнозы, но не исключает возможности диагностики СД по уровню глюкозы крови.
Перевод HbA1c из % в ммоль/моль:
(HbA1c % × 10,93) – 23,5 = HbA1c ммоль/моль
Перевод HbA1c из ммоль/моль в %:
(0,0915 × HbA1c ммоль/моль) + 2,15 = HbA1c %
В случае отсутствия симптомов острой метаболической декомпенсации диагноз должен быть поставлен на основании двух цифр, находящихся в диабетическом диапазоне, например, дважды определенный HbA1c или однократное определение HbA1c + однократное определение уровня глюкозы крови.
Ограничения в использовании HbA1c:
- При стремительном развитии СД, например, в некоторых случаях СД 1 типа у детей, уровень HbA1c может не быть значимо повышенным, несмотря на наличие классических симптомов СД.
- Лабораторная и индивидуальная вариабельность, в связи с чем решения об изменении терапии должны проводиться с учетом других данных оценки гликемического контроля.
- Ситуации, которые влияют на обмен эритроцитов (анемии различного генеза, гемоглобинопатии, недавнее переливание крови, использование препаратов, стимулирующих эритропоэз, терминальная почечная недостаточность, беременность). В этом случае возможно определение уровня фруктозамина, который оценивает уровень глюкозы плазмы за 3 недели, но его диагностические и целевые значения пока не разработаны.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Для дифференциальной диагностики СД 1 типа, СД 2 типа, моногенных форм СД может быть проведено определение базального и стимулированного уровня С-пептида, аутоантител к инсулину (IAA), глютаматдекарбоксилазе (GAD), тирозинфосфатазе (IA-
2 и IA-2β), поверхностным антигенам (ICA), транспортеру цинка (ZnT-8), а также выполнено молекулярно-генетическое исследование.
